Во месецот со најмалку дена во годината, во месецот кој оваа година е редок по своите ретки 29 дена и во месецот кој пациентите со ретки болести го идентификуваат како свој по шести пат ќе се обидеме поблиску да Ве запознаеме со ретките болести од кои заболува и со кои се соочува и живее населението од нашиот охридско – струшки регион. Да ги дознаеме предизвиците и проблемите со кои се соочуваат. Како ја добиваат дијагнозата? Дали има некаков лек? Колку и дали воопшто се пристапни и достапни лековите?
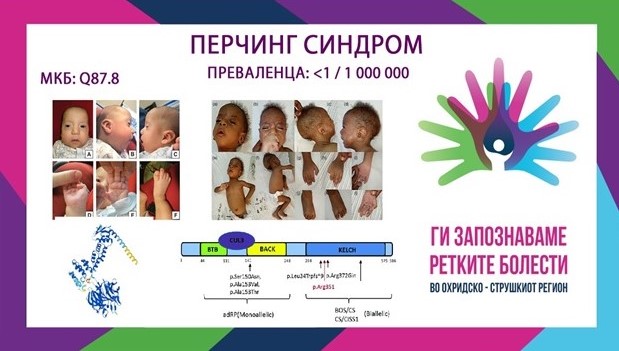
ПЕРЧИНГ СИНДРОМ/PERCHINGSYNDROME
MKБ-10Q87.8
ПРЕВАЛЕНЦА – непозната, само 20 случаи се опишани во литературата.
ВОВЕД
Синдромот на Перчинг е автосомно-рецесивномултисистемскo нарушување предизвикано од хомозиготни или сложени хетерозиготни патогени варијанти во генот KLHL7 (KelchLikeFamilyMember 7 (KLHL7)), кој се наоѓа на хромозомот 7p15 и кој се манифестира со глобален развоен застој, карактеристични црти на лицето, тешкотии со хранењето и дишењето, хипотонија и контрактури. Акронимот „PERCHING“ по кој е насловен синдромот се однесува на најкарактеристичните фенотипски елементи кои се манифестираат при истиот:
P–постурални и палатални абнормалности
E–егзофталмус и проблеми со зависност/хранење од ентерална цевка
R– респираторен дистрес и ретинитис пигментоза
C–контрактури и камптодактилија
H–хипертелоризам и хирзутизам
I– IUGR/дефицит во растот и интелектуална попреченост/задоцнување во развојот
N–nevusflammeus и невролошки малформации
G– лицево Гешталт/гримасирање и генитоуринарни абнормалности
Иако фенотипскиот спектар на овој синдром е широк и мултисистемски, постои специфична дисморфична презентација која може да го олесни клиничкото препознавање на овој синдром. Од првиот објавен случај за овој синдром во 2016 година (Angiuset 2016), до денес, во литературата се опишани само околу 20 пациенти.
ЕТИОЛОГИЈА
Мутациите во KLHL7 претходно се опишани како причина за констелација на клинички наоди со описи и на синдромот Cripponi (CS) – исто така познат и како Синдром на потење предизвикан од тип 1 (CISS1) и како презентација слична на БОС (Boring-Opitz синдром (BOS)). Афектираните деца имаат дизморфични карактеристики и доцнење во развојот и нивните клинички карактеристики не се преклопуваат доследно со фенотипски сличните CS/CISS1 и BOS. Исто така, афектираните браќа и сестри на опишаните случаи се разликуваат помеѓу себе што укажува на постоење на определена варијабилност во клиничката слика кај овој синдроом. Генот KLHL7 е лоциран на краткиот крак на хромозомот 7 и кодира протеин од семејството Келч. Протеините од семејството Келч играат важна улога во посредувањето на протеинските интеракции и затоа се важни за различни клеточни активности, вклучувајќи пролиферација, диференцијација, миграција, одржување на цитоскелетната структура и генска експресија. Прецизната функција на протеинскиот производ на KLHL7 останува нејасна, но познато е дека овој протеин е вклучен во препознавањето на супстратот како дел од комплексите на кулин-3 (CUL3) кои содржат Е3 убиквитинлигаза кои посредуваат деградација на протеозомот.
СИМПТОМИ И ДИЈАГНОСТИЦИРАЊЕ
Заедничките невроразвојни, мускулно-скелетни, дизморфни и други клинички манифестации на пациентите со биалелни мутации во генот KLHL7, дефинираат нова мултисистемска болест.
Дијагностицирањето на синдромот Перчинг вклучува низа чекори, како на пример:
1. Клиничка евалуација
Предгенетското тестирање, вообичаено се врши темелна клиничка евалуација од медицински генетичар и/или педијатар (детски невролог). Оваа евалуација може да вклучува преглед на личната и семејната историја на пациентот
2. Собирање биолошки примероци од пациентот
Биолошкиот примерок најчесто е крв или плунка
3. Екстракција на ДНК
Од примерокот се екстрахира ДНК
4. Генетско тестирање може да вклучи разни методи за откривање на мутации во KLHL7
Секвенционирање кое се спроведува според Sanger
Секвенционирање со следната генерација технологии (NGS) кои овозможуваат симултано секвенционирање на повеќе гени, вклучувајќи го и KLHL7. Вообичаено се користат насочени генски панели или секвенционирање на цел егзом (WES).
Арејната компаративна геномска хибридизација (aCGH) може да идентификува поголеми геномски промени, како што се делеции или дупликации во генот KLHL7
5. Анализа на резултатите и интерпретација на генетските варијанти
Добиените генетски резултати се анализираат со разни биоинформатички алатки кои овозможуваат споредба на ДНК-секвенцата добиена од пациентот со референтна секвенца, и пребарување набазите на податоци за вообичаената генетска варијабилност во популацијата, како и на базите податоци за генетска варијабилност поврзана со болести
6. Толкување на варијантата
Идентификуваните генетски варијанти се проценуваат за нивната потенцијална патогеност од страна на молекуларните генетичари, генетските советници и клиничките генетичари
Важно е да се напомене дека генетското тестирање во медицинската генетика треба да биде спроведено во соодветно акредитирана генетска лабораторија од страна на квалификувани генетичари или генетски советници. Дополнително, толкувањето на генетските варијанти може да биде сложено и често неопходна е консултација со специјалист по генетика за целосно да се разберат клиничките импликации на болеста и да се овозможи понатамошно планирање на семејството.
ПОСЛЕДИЦИ
Прогнозата зависи од тежината на тешкотиите со хранење и дишење, хипотонијата и од контрактурите.
ТРЕТМАН
Лекувањето на оваа болест е главно симптоматско и во зависност од клиничката манифестација често се јавува потреба од мултидисциплинарен пристап кој вклучува детски невролог, генетичар, ортопед, пулмолог, ендокринолог, офталмолог и/или детски хирург. За прогнозата на оваа болест не може да се каже многу со оглед на малиот број опишани пациенти и краткиот период на следење на природниот тек на болеста.
Генетско советување
Доколку се идентификува генетската причина за болеста кај пациентот, вообичаено на родителите им се нуди тестирање за носителство. Најчесто, двајцата родители се здрави носители за оваа автосомно-рецесивна болест, и во тој случај, веројатноста за повторување на болеста во која било следна бременост е 1 од 4 или 25%. Генетската дијагноза отвора можности за пошироко каскадно тестирање за носителство во семејството и овозможува планирање на семејството во смисла на пренатална или предимплантациона генетска дијагностика.